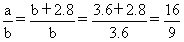| 发现之旅 |  |
 |
 |
 |
固体测量方式 |
液体测量方式 |
气体测量方式 |
| 深入思考 |  |
常见的物理量
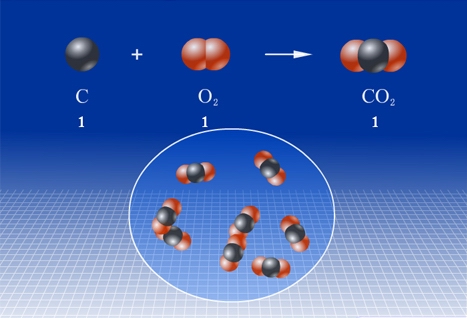
1 mol的任何粒子的粒子数叫做阿伏加德罗常数。阿伏加德罗常数的符号为NA ,通常使用 6.02×1023 mol -1 这个近似值。物质的量、阿伏加德罗常数与粒子数(符号为N)之间存在着下述关系:
 |
 |
1 molO原子中约含有6.02×1023个O |
1 molC原子中约含有6.02×1023个C |
物质的量(n)、物质的质量(m)和物质的摩尔质量(M)之间存在着下式所表示的关系:
 |
 |
1mol水(18g) |
1mol铝(27g) |
| 学有所用 |  |
摩尔一词来源于拉丁文moles,原意为大量和堆集。早在20世纪40至50年代,就曾在欧美的化学教科书中作为克分子量的符号。1961年,化学家E.A.Guggenheim将摩尔称为“化学家的物质的量”,并阐述了它的涵义。同年,在美国《化学教育》杂志上展开了热烈的讨论,大多数化学家发表文章表示赞同使用摩尔。1971年,在由41个国家参加的第14届国际计量大会上,正式宣布了国际纯粹和应用化学联合会、国际纯粹和应用物理联合会和国际标准化组织关于必须定义一个物质的量的单位的提议,并作出了决议。从此,“物质的量”就成为了国际单位制中的一个基本物理量。摩尔是由克分子发展而来的,起着统一克分子、克原子、克离子、克当量等许多概念的作用,同时把物理上的光子、电子及其他粒子群等“物质的量”也概括在内,使在物理和化学中计算“物质的量”有了一个统一的单位。
摩[尔]是微观粒子的计量单位,它所量度的对象是构成物质的基本粒子(如原子、分子、离子、电子等)或是它们的特定组合。即凡是可以使用化学式表示的微观粒子或它们的特定组合,都可以使用摩[尔]来量度。因此,在使用摩[尔]时,必须要指明所量度的微观粒子的名称和微观粒子特定组合的名称。在表示所量度的微观粒子的名称和微观粒子特定组合的名称时,必须要使用名称的符号,而不能使用中文。例如,说1mol氢,概念就模糊了,是毫无意义的,违反了物质的量的单位的使用规则。因为氢是元素的名称,不是粒子的名称,也不是粒子的符号或化学式。
| 沙场练兵 |  |
1.
设 NA 代表阿伏加德罗常数,下列说法正确的是
( )
A. 2.3g 金属钠全部变成钠离子时失去的电子数目为 0.2NA
B. 2g 氢气所含原子数目为NA
C. 17gNH3所含的电子数为 10NA
D. NA 个氧分子和NA 个氢分子的质量比等于16 :1
2. 下列说法中正确的是( )
A. 1molO2的质量是 32g /mol
B. H2的摩尔质量是 2g
C. 1molH+的质量是 1g
D. 对原子而言,摩尔质量就是原子量
E. 每摩任何物质都含有 6.02 × 1023个微粒
3.
设一个12C原子的质量为ag ,一个R 原子的质量为bg ,阿伏加德罗常数为NA ,则R的相对原子质量可以表示为
( )
A.
![]() B.
B.
![]() C.
bNA D.
aNA
C.
bNA D.
aNA
4.
下列叙述正确的是
( )
A .同质量的H2与Cl2相比,H2的分子数多
B .28g氮气所含的原子数目为NA
C .0.1molH2SO4含有氢原子数精确值为1.204×1023
D .醋酸的摩尔质量与NA个醋酸分子的质量在数值上相等
5.
含有相同质量的氧原子的 NO 、 NO2 、 N2O3 、 N2O5 和 N2O 中,含氮原子的质量比为
( )
A. 1 :2 :3 :5 :1
B. 1 :2 :3 :4 :1
C. 16 :30 :20 :10 :5
D. 30 :15 :20 :12 :60
6.
在反应 X + 2Y === R + 2M 中,已知 R 和 M 的摩尔质量之比为 22 :9 ,当 1.6gX 与 Y 完全反应后,生成 4.4gR 。则在此反应中 Y 和 M 的质量之比为
( )
A. 16 :9 B. 23 :9 C. 32 :9 D. 46 :9
7.
相等物质的量的CO和CO2相比较,下列有关叙述中正确的是
( )
A. 它们所含的分子数目之比为 1 ∶ 1
B. 它们所含的 O 原子数目之比为 2 ∶ 1
C. 它们所含的 C 原子数目之比为 1 ∶ 1
D. 它们所含的原子总数目之比为 3 ∶ 2
E. 它们所含的电子数目之比为 11 ∶ 7
8.
若规定 12C的相对原子质量为 100 ,并将用12C规定的其他物理量的值作相应的调整,则下列各项发生变化且为原来数值 12/100 的是
( )
A.氧的相对原子质量
B.水的摩尔质量
C.阿伏加德罗常数
D.98 g 硫酸的物质的量
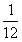 作为标准,该原子的绝对质量与其相比所得的比值。因此得出R原子的相对原子质量=
作为标准,该原子的绝对质量与其相比所得的比值。因此得出R原子的相对原子质量=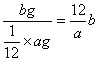 。B选项是正确的。还可以从另一个角度考虑。相对原子质量与摩尔质量在数值上是相等的。因此可以求出1molR原子的质量。因为1molR原子有阿伏加德罗常数个原子,而已知一个R原子的质量为bg,所以1molR原子的质量为b
。B选项是正确的。还可以从另一个角度考虑。相对原子质量与摩尔质量在数值上是相等的。因此可以求出1molR原子的质量。因为1molR原子有阿伏加德罗常数个原子,而已知一个R原子的质量为bg,所以1molR原子的质量为b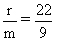 。又假设参加反应的Y为ag,生成M为bg。根据质量守恒定律可列出关系式:1.6+a=4.4+b。化简得a=b+2.8。
。又假设参加反应的Y为ag,生成M为bg。根据质量守恒定律可列出关系式:1.6+a=4.4+b。化简得a=b+2.8。