| 发现之旅 |  |

铝锅
| 深入思考 |  |
铝是一种银白色的轻金属,纯净的铝很软,可以压成很薄的箔,现在包糖果、香烟的“银纸”,其实大都是铝箔。

金属铝
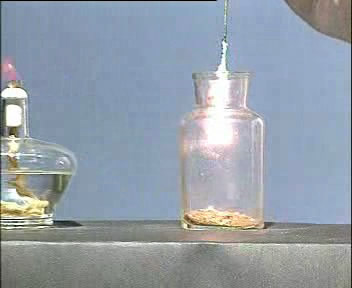
用点燃的木条放在两支试管口,可以发现:铝与氢氧化钠反应产生的气体可以点燃,说明产生的是氢气。
| 学有所用 |  |
人类的好伴侣--铝
1854年,法国化学家德维尔把铝矾土、木炭、食盐混合,通人氯气后加热得到NaCl,AlCl3复盐,再将此复盐与过量的钠熔融,得到了金属铝。这时的铝十分珍贵,据说在一次宴会上,法国皇帝拿破仑第三独自用铝制的刀叉,而其他人都用银制的餐具。泰国当时的国王曾用过铝制的表链;1955年巴黎国用博览会上,展出了一小块铝,标签上写到:“来自粘土的白银”,并将它放在最珍贵的珠宝旁边,直到1889年,伦敦化学会还把铝和金制的花瓶和杯子作为贵重的礼物送给门捷列夫。1886年,美国的豪尔和法国的海朗特,分别独立地电解熔融的铝矾土和冰晶石的混合物制得了金属铝,奠定了今天大规模生产铝的基础。
近一个世纪的历史进程中,铝的产量急剧上升,到了20世纪60年代,铝在全世界有色金属产量上超过了铜而位居首位,这时的铝已不单属于皇家贵族所有,它的用途涉及到许多领域,大至国防、航天、电力、通讯等,小到锅碗瓢盆等生活用品。它的化合物用途非常广泛, 不同的含铝化合物在医药、有机合成、石油精炼等方面发挥着重要的作用。
| 沙场练兵 |  |
1. 下列各组离子中,能在酸性溶液里大量共存,并且溶液呈无色透明溶液的是( )
A. ![]()
B.![]()
C.
![]()
D.
![]()
2.下列叙述不正确的是( )
A.含金属元素的离子不一定是阳离子
B.金属元素的原子只能被还原,而阳离子只有氧化性
C.金属阳离子被还原不一定得到金属单质
D.元素由化合态变为游离态一定被氧化
3.等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是( )
A、甲乙中都是铝过量
B、甲中铝过量、乙中碱过量
C、甲中酸过量、乙中铝过量
D、甲中酸过量、乙中碱过量
4.将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是( )
A、稀硝酸 B、稀盐酸 C、硝酸铜 D、氢氧化钠
5.铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、卷帘门、防护栏等。下列与这些用途无关的性质是( )
A、不易生锈 B、导电性好 C、密度小 D、强度高
6.把Ba(OH)2溶液滴入明矾溶液中,使SO42-全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
A、Al3+ B、Al(OH)3 C、AlO2- D、Al3+ 和Al(OH)3


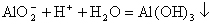
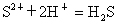
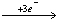 Al或2Cl-
Al或2Cl- 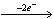 Cl2,故不能说一定氧化。
Cl2,故不能说一定氧化。