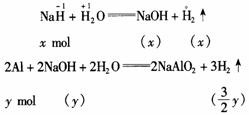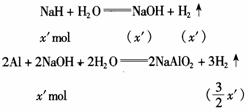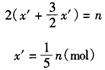2005-2006学年度综合练习(二) 理科综合能力测试-化学 第Ⅰ卷(选择题) 每小题6分。在每小题列出的四个选项中,选出符合题目要求的一项。以下数据可供解题时参考: 可能用到的相对原子质量:H
5.下列各项叙途中不正确的是 A.具有相同质子数的微粒不一定都属于同种元素 B.有单质生成的化学反应不一定都属于氧化还原反应 C.凡含有阳离子的化合物必定含有阴离子 D.凡具有正四面体结构的分子,其共价键间的夹角必为109°28′ 6.已知硫酸铅难溶于水,也难溶于硝酸,却溶于饱和
当在
A.
B.
C.
D.
7.没
A.在标准状况下, B. C. D.常温常压下,
8.下列说法正确的是 A.在
B.由多种非金属元素组成的化合物一定是共价化合物 C.HF、HCl、HBr、HI四种物质的沸点依次升高 D.晶体熔化时化学键不一定发生断裂
9.现有可逆反应:
A.a<0,m+n<x B.a<0,m+n>x C.a>0,m+n<x D.a>0,m+n>x 10.下列关于电解质溶液的叙述中正确的是 A.
B.常温下1mol/L的
C.溶质的物质的量浓度相同的
D.常温下,某溶液中由水电离出的
11.将一定量的金属锌跟100mL、18.3
A.生成的气体只能是二氧化硫 B.加入的金属锌质量是 C.生成的
12.医学专家提出,人体中细胞膜内的葡萄糖和细胞膜外的富氧液体与细胞膜构成了微 型的生物原电池,有关这个原电池的下列判断正确的是 A.负极的电极反应可能是:
B.正极的电极反应可能是:
C.正极反应主要是:
D.负极反应主要是:
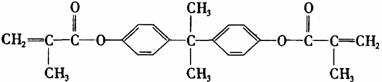
第Ⅱ卷(非选择题) 25.(16分)双酚-A的二甲基丙烯酸酯是一种能使人及动物的内分泌系统发生紊乱,导致生育及繁殖异常的环境激素,其结构简式为:
它在一定条件下水解可生成双酚-A和核酸H两种物质。 Ⅰ.(1)双酚-A的分子式为________;下列关于它的叙述中正确的是________(填写字母)。 A.与苯酚互为同系物 B.可以和
C.分子中所有的碳原子可能在同一平面上 D.与浓溴水反应,最多可以消耗
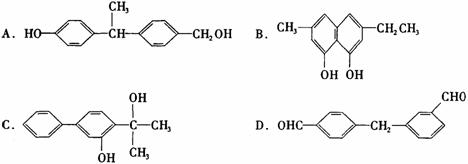
(2)下列物质中与双酚-A互为同分异构体的是________。(填写字母)。
Ⅱ.已知与
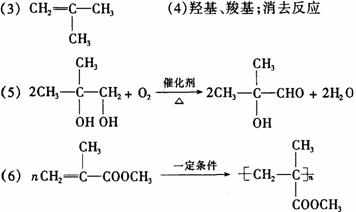
羧酸H可以由以下途径制得:
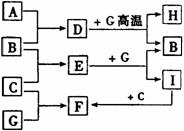
(3)C的结构简式______________________________。 (4)G中所含官能团为______________(镇名称),⑤的反应类型为____________。 (5)反应③的化学方程式为_____________________。 (6)羧酸H与甲醇反应后得到的酯,能形成一种高分子化合物,可用于制造高级光学仪器透镜,请写出该酯在一定条件下生成此高分子化合物的化学反应方程式________________________________________________________________。 26.(14分)单质A、B、C在常温下均为气态,分别由甲、乙、丙三种短周期元素组成;丙元素的原子结构中次外层电子数比最外层电子数多1;G是常见的金属单质,D在常温下为液态,H是一种黑色晶体。各物质间的转化关系如下图所示(反应条件多数已略去):
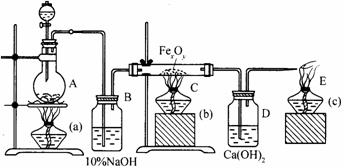
请回答: (1)甲、乙两种元素还可形成一种含有4个原子核和18个电子的化合物,该化合物的电子式为__________________; (2)实验室制取C的离子反应方程式为________________________;G与D在高温下反应的化学方程式为__________________________; (3)B在C中燃烧的现象是______________________________;在通常状况下, (4)以石墨为电极电解E的水溶液,其阳极反应式为_____________________________; (5)实验室检验F的水溶液中所含金属阳离子的操作方法________________________。 27.(18分)在下图所示的实验装置中,往A中放入草酸和浓
试回答: (1)气体甲是__________,气体乙是__________,在A装置中发生的化学方程式为______________________________。 (2)在B装置中发生反应的离子方程式为______________________________。 (3)在C装置中
(4)本实验中用到3个酒精灯(a)、(b)、(c),开始实验时点燃酒精灯的先后顺序是__________,理由是____________________;实验结束时,熄灭酒精灯的顺序是__________,理由是____________________。 (5)用气体乙还原 (6)若装置A中产生的气体长时间通入B中,则在B中会有白色晶体析出,发生的反应为(写化学方程式)_____________________________;当气体长时间通过D时,开始产生的白色沉淀又逐渐减少,发生反应的化学方程式为_____________________________。 28.(12分)氢化钠(NaH)是一种离子化合物,当NaH跟水反应时,生成物是NaOH和H2。现有NaH和铝粉的混合物mg,跟足量的水充分反应,共收集到氢气的质量为ng。 (1)试写出相关反应的化学方程式,属于氧化还原反应的标出电子转移方向和总数。 (2)计算混合物中铝粉的质量。 参考答案: 5.D。 6.A。 7.D 8.D 9.B 10.C 11.C。 12.D。 25.(共16分,每空2分)(1)
26.(共14分)(1)(2分)
(2)(每空2分)
(3)(每空2分)氢气在氯气中安静燃烧,发出苍白色火焰;
(4)(2分)
(5)(2分)取少量溶液置于一支试管中,滴入几满KSCN溶液,观察溶液是否变红色,如果变红,则证明有
27.(18分) (1)气体甲是CO2,气体乙是CO。
(2)
(3)
(4)a,c,b;赶走装置中的空气,防止CO与O2混合爆炸。 b,a,c;防止液体倒吸并防止铁被氧化。 (5)
(6)
28.(12分) (1)
(2)①当NaOH过量时,设NaH的物质的量为x,铝的物质的量为y(y>x),则有如下关系:(此时铝全部反应完毕)
NaOH过量:
依题意列方程:
解得:
②当铝粉过量时,设NaH的物质的量为x′,铝粉的物质的量为y′(y′< x′),此时,NaH不足量,则有如下关系:
依据题意列方程:
铝粉的质量为:
|